Diagrama de Pauling
O diagrama de Pauling nada mais é do que um método de distribuir os elétrons na elétrosfera do átomo e dos íons. Este método foi desenvolvido pelo químico norte-americano Linus Pauling (1901-1994), com base nos cálculos da mecânica quântica, em virtude de este ter passado um tempo junto com seus fundadores: Borh, Shcrödinger e Heisenberg. Pauling provou experimentalmente que os elétrons são dispostos nos átomos em ordem crescente de energia, visto que todas as vezes que o elétron recebe energia ele salta para uma camada mais externa a qual ele se encontra, e no momento da volta para sua camada de origem ele emite luz, em virtude da energia absorvida anteriormente. Baseado na proposição de Niels Borh de que os elétrons giram ao redor do núcleo, como a órbita dos planetas ao redor do sol.
Uma lâmpada fluorescente, por exemplo, ela contém uma substância química em seu interior, obviamente formada por átomos, os elétrons presentes na eletrosfera destes átomos, ao receber a energia elétrica são excitados, e começam a saltar para outras camadas e ao retornarem emitem a luz.
1s2 2s2 2p6 3s2 3p6 4s2 3d104p6 5s2 4d10 5p6 6s2 4f14 5d106p6 7s2 5f146d10 7p6 …
https://www.infoescola.com/quimica/diagrama-de-pauling/
De:Rubens Fernandes
EIEL-11A


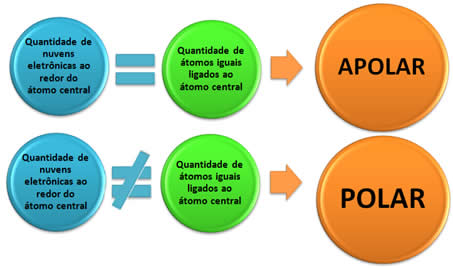
.jpg)





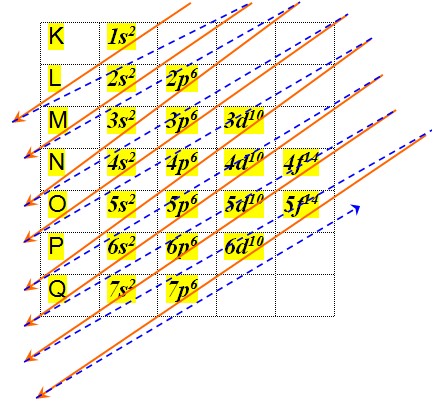
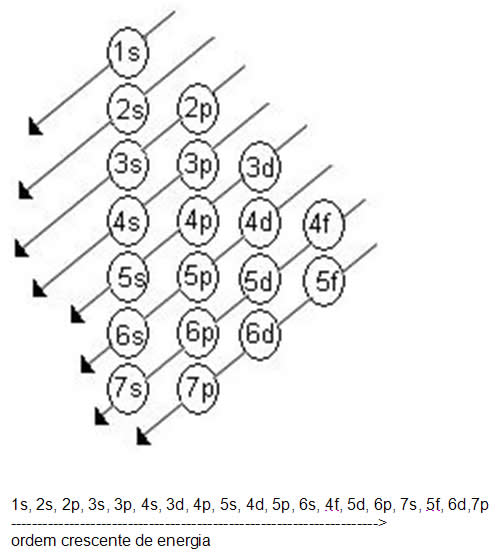






 u Fórmula Eletrônica
u Fórmula Eletrônica











